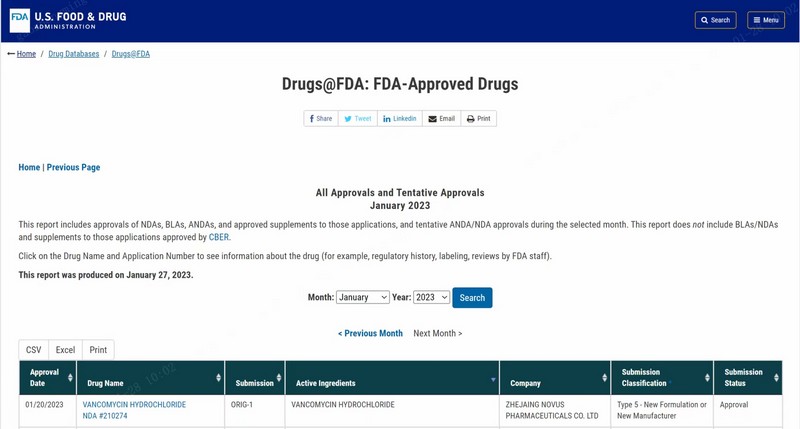
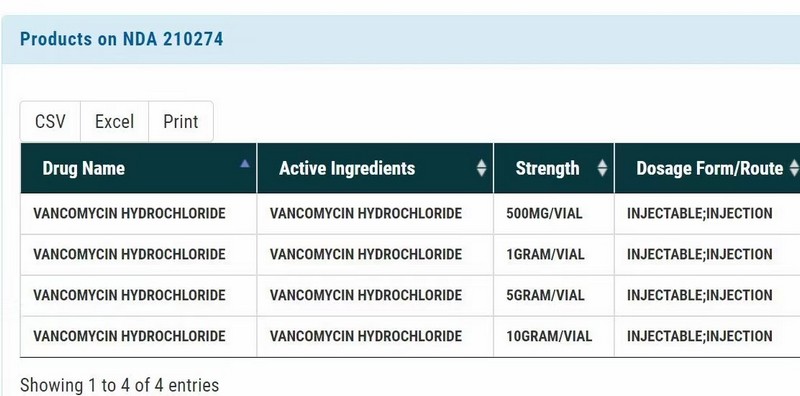
2023年1月21日,农历壬寅年除夕,在这样一个国人辞旧迎新、吃团圆饭的喜庆日子里,浙江医药股份有限公司下属子公司浙江创新生物有限公司收到美国食品药品监督管理局(FDA)核准签发的注射用盐酸万古霉素 500mg/瓶、1g/瓶、5g/瓶、10g/瓶四个规格按 505(b)(2)申报的 NDA(New Drug Application)新药申请批准信。这是对一种全新的无菌药品商业生产模式的认可,代表着民族药企又取得了一个在要求最高、监管最严的欧美发达国家市场展示自我和同台竞争的机会,这对于浙江医药和创新生物都是具有里程碑意义的重大事件。另一方面,承载本次获批产品的生产技术平台具有工艺流程全封闭、高产量、适合大小规格产品、连续工艺、生产成型时间短等特点,可以生产常规冻干工艺无法生产或难以生产的产品,优势十分明显;实践证明以这种全新的生产方式来制备高难度药品这条路是走得通的,这项突破性的技术平台,将具有良好的前景,预期在今后能为公司带来较大的效益。
回顾FDA的四轮审评历程,第一次再递交是对第一轮NDA审评CRL100多项缺陷整改和完整答复;第二轮审评中除了FDA因疫情无法现场检查外,NDA文件已无其它技术问题;第三、第四轮审评重点在于说明书和标签,其中第四轮审评时FDA启动了设施的记录审查,并在本轮审评后最终获得NDA批准。
多年的耕耘和坚持终于有了丰硕的成果,成果的取得来自于浙江医药及创新生物董事会和经营层坚定如磐的决心和科学有力的指导,来自于注射用盐酸万古霉素NDA申报项目组和创新生物全体干部员工凝心聚力、攻坚克难和精诚合作。光荣属于每一个为之付出过努力的浙药人、创新人!
成绩属于过往,创新生物将以此为新的起点,新的征程,开拓创新,勇敢前行,共同建设更加美好的未来!
看创新,鲲鹏起,北海可期!
![]()

文:创新生物办公室 俞志荣
图:网络截图